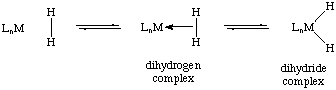Les complexes de dihydrogène sont des complexes σ ayant une molécule de dihydrogène H2 intacte comme ligand,. On en connaît plusieurs centaines. L'exemple type est le complexe W(CO)3(PCy3)2(H2). Ces composés chimiques sont des intermédiaires dans les réactions catalysées par des métaux impliquant de l'hydrogène. Les plus courants sont des complexes cationiques de métaux de transition à géométrie octaédrique.
Sous l'effet de la complexation, la liaison H–H atteint une longueur de 81 à 82 pm, comme indiqué par diffraction de neutrons, soit un allongement d'environ 10 % par rapport à sa longueur de 74 pm dans la molécule d'hydrogène H2 libre ; l'élongation atteint par exemple 20 % dans le cas du W(CO)3(PiPr3)2(H2), à 89 pm. Certains complexes contenant plusieurs ligands hydrogène, comme les polyhydrures, présentent également des contacts H–H rapprochés. On considère généralement qu'une distance entre atomes d'hydrogène inférieure à 100 pm correspond davantage à un complexe de dihydrogène tandis qu'une distance supérieure à 100 pm correspond davantage à un dihydrure.
La RMN du proton est la principale méthode de caractérisation des complexes de dihyrogène. La constante de couplage JHD est un indicateur utile de la force de liaison entre l'hydrogène et le deutérium dans les complexes HD. Elle vaut ainsi 43,2 Hz pour la molécule HD mais 33,5 Hz dans W(HD)(CO)3(PiPr3)2. Les complexes de dihydrogène ont généralement des temps de relaxation (en) plus courts que les hydrures correspondants.
Les complexes de difluor sont apparentés aux complexes de dihydrogène mais présentent une configuration η1-F2 au lieu de la structure η2-H2 de ces derniers.
Méthodes de synthèse
Il existe deux méthodes de préparation impliquant une réaction directe avec de l'hydrogène H2 gazeux. La première fait intervenir l'addition de H2 sur un centre métallique insaturé, comme dans le cas de W(CO)3(PiPr3)2(H2). Dans ce cas, le complexe insaturé présente une interaction agostique déplacée par H2. Dans d'autres cas, H2 déplace des ligands anioniques, parfois même des halogénures. Le traitement de l'hydrure de chlorobis(dppe)fer HFeCl(dppe)2 (où dppe est le ligand bidentate 1,2-bis(diphénylphosphino)éthane) avec du tétrafluoroborate de sodium NaBF4 sous atmosphère d'hydrogène est un exemple :
- HFeCl(dppe)2 NaBF4 H2 ⟶ [HFe(H2)(dppe)2]BF4 NaCl.
De nombreux hydrures de métal peuvent être protonés pour donner des complexes de dihydrogène :
- H2Fe(dppe)2 H ⟶ [HFe(H2)(dppe)2] .
Dans ce genre de cas, l'acide provient d'un anion non coordinant, comme l'acide de Brookhart.
Notes et références
- Portail de la chimie